Giải bài tập hóa 9
Trang 1 trong tổng số 1 trang
 Giải bài tập hóa 9
Giải bài tập hóa 9
Tính chất hóa học của bazơ
1. a) Có phải tất cả các chất kiềm đều là bazơ không? Dẫn ra công thức hóa học của ba chất để kiềm để minh họa.b) Có phải tất cả các bazơ đều là chất kiềm không? Dẫn ra công thức hóa học của ba chất để kiềm để minh họa.
Hướng dẫn.
a) Vì kiềm là một loại bazơ tan được trong nước nên tất cả các chất kiềm đều là baz ơ.
Thí dụ: NaOH, KOH, Ba(OH)2.
b) Vì không phảo mọi bazơ đều tan trong nước nên không phải tất cả các bazơ đều là chất kiềm.
Thí dụ: Các bazơ Cu(OH)2,Mg(OH)2, Fe(OH)3 ..không phải là chất kiềm.
2. Có những bazơ sau: Cu(OH)2, NaOH, Ba(OH)2. Hãy cho biết những bazơ nào
a) Tác dụng được với với dung dịch HCl. b) Bị nhiệt phân hủy.
c) Tác dụng được CO2. d) Đổi màu quỳ tím. thành xanh.
Hướng dẫn.
a) Tất cả các bazơ đều tác dụng với axit HCl:
Cu(OH)2 + HCl → CuCl2 + 2H2O
NaOH + HCl → NaCl + H2O
Ba(OH)2 + 2HCl → BaCl2 + 2H2O
b) Chỉ có Cu(OH)2 là bazơ không tan nên bị nhiệt phân hủy:
Cu(OH)2
c) Những bazơ tác dụng với CO2 là NaOH và Ba(OH)2.
NaOH + CO2 → Na2CO3 + H2O
Ba(OH)2 + CO2 → BaCO3 + H2O
d) Những baz ơ đổi màu quỳ tím thành màu xanh là NaOH và Ba(OH)2.
3. Từ những chất có sẵn là Na2O, CaO, H2O. Hãy viết các phương trình hóa học điều chế các dung dịch bazơ.
Hướng dẫn.
Phương trình hóa học điều chế các dung dịch bazơ:
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
4*. Có 4 lọ không nhãn, mỗi lọ đựng một dung dịch không màu sau: NaCl, Ba(OH)2, NaOH, Na2SO4. Chỉ được dùng quỳ tím, làm thế nào nhận biết dung dịch đựng trong mỗi lọ bằng phương pháp hóa học? Viết các phương trình hóa học.
Lời giải.
Lấy từ mỗi lọ một mẫu hóa chất (gọi là mẫu thử) để làm thí nghiệm nhận biết.
Cho quỳ tím vào mẫu thử từng chất và quan sát, thấy:
- Những dung dịch làm quỳ tím đổi màu là: NaOH và Ba(OH)2, (nhóm 1).
- Những dung dịch không làm quỳ tím đổi màu là: NaCl, Na2SO4 (nhóm 2).
Để nhận ra từng chất trong mỗi nhóm, ta lấy một chất ở nhóm (1), lần lượt cho vào mỗi chất ở nhóm (2), nếu có kết tủa xuất hiện thì chất lấy ở nhóm (1) là Ba(OH)2 và chất ở nhóm (2) là Na2SO4. Từ đó nhận ra chất còn lại ở mỗi nhóm.
Phương trình phản ứng: Ba(OH)2 + Na2SO4 → BaSO4 + NaOH
5. Cho 15,5 gam natri oxit Na2O tác dụng với nước, thu được 0,5 lít dung dịch bazơ.
a) Viết phương trình hóa học và tính nồng độ mol của dung dịch bazơ thu được.
b) Tính thể tích dung dịch H2SO4 20% có khối lượng riêng 1,14 g/ml cần dùng để trung hòa dung dịch bazơ nói trên.
Lời giải.
Số mol Na2O = 15,5:62 = 0,25 mol
a) Khi cho Na2O xảy ra phản ứng, tạo thành phản ứng dung dịch có chất tan là NaOH.
Na2O + H2O → 2NaOH
Phản ứng: 0,25 → 0,05 (mol)
500 ml =
b) Phương trình phản ứng trung hòa dung dịch:
2NaOH + H2SO4 → Na2SO4 + 2H2O
Phản ứng: 0, 5 → 0,25 0,25 (mol)
mH2SO4 = 0,25x98 = 24,5 g
mdd H2SO4 =
mdd, ml =
Một số oxit quan trọng
Bài 1. Bằng phương pháp hóa học nào có thể nhận biết được từng chất trong mỗi dãy chất sau ?a) Hai chất rắn màu trắng là CaO và Na2O.
b) Hai chất khí không màu là CO2 và O2.
Viết các phương trình hóa học.
Bài giải:
Lấy mỗi chất cho vào mỗi cốc đựng nước, khuấy cho đến khi chất cho vào không tan nữa, sau đó lọc để thu lấy hai dung dịch. Dẫn khí CO2 vào mỗi dung dịch:
Nếu ở dung dịch nào xuất hiện kết tủa (làm dung dịch hóa đục) thì đó là dung dịch Ca(OH)2, suy ra cho vào cốc lúc đầu là CaO, nếu không thấy kết tủa xuất hiện chất cho vào cốc lúc đầu là Na2O.
Các phương trình hóa học đã xảy ra:
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
2NaOH + CO2 → H2O + Na2CO3 (tan trong nước)
Ca(OH)2 + CO2 → H2O + CaCO3 (kết tủa không tan trong nước)
Bài 2: Hãy nhận biết từng chất trong mỗi nhóm chất sau bằng phương pháp hóa học.
a) CaO, CaCO3; b) CaO, MgO.
Viết phương trình hóa học
Bài giải:
a) Lấy mỗi chất cho ống nghiệm hoặc cốc chứa sẵn nước,
- Ở ống nghiệm nào thấy chất rắn tan và nóng lên, chất cho vào là CaO
- Ở ống nghiệm nào không thấy chất rắn tan và không nóng lên, chất cho vào là CaCO3
Phương trình hóa học:
CaO + H2O → Ca(OH)2
b) Thực hiện thí nghiệm như câu a) chất không tan và ống nghiệm không nóng lên là MgO.
Bài 3. 200ml dung dịch HCl có nồng độ 3,5M hòa tan vừa hết 20 g hỗn hợp hai oxit CuO và Fe2O3
a) Viết các phương trình hóa học
b) Tính khối lượng của mỗi oxit có trong hỗn hợp ban đầu.
Bài giải:
Số mol HCl = 3,5 . 0,2 = 0,7 mol
Gọi x, y là số mol của CuO và Fe2O3
a) CuO + 2HCl → CuCl2 + H2O
Phản ứng x → 2x x (mol)
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
Phản ứng: y → 6y 2y (mol)
Theo khối lượng hỗn hợp hai oxit và theo số mol HCl phản ứng, ta lập được hệ phương trình đại số:

Giải phương trình (1) (2) ta được x = 0,05 mol; y = 0,1 mol
b) mCuO = 0,05 . 160 = 4 g
m Fe2O3 = 20 – 4 = 16 g
Bài 4. Biết 2,24 lít khí CO2 (đktc) tác dụng vừa hết với 200 ml dung dịch Ba(OH)2 sản phẩm là BaCO3 và H2O
a) Viết phương trình hóa học
b) Tính nồng độ mol của dung dịch Ba(OH)2 đã dùng
c) Tính khối lượng chất kết tủa thu được.
Bài giải:
Số mol CO2 =
a) CO2 + Ba(OH)2 → BaCO3 + H2O
Phản ứng: 0,1 → 0,1 0,1
b) Số mol Ba(OH)2 có trong 200 ml dung dịch là 0,1 mol
CM Ba(OH)2 =
c) Chất kết tủa thu được sau phản ứng là BaCO3 có số mol là 0,1
m BaCO3 = 0,1 x 197 = 19,7 g
Một số oxit quan trọng(tiếp)
Bài 1:Viết phương trình hóa học cho mỗi chuyển đổi sau:
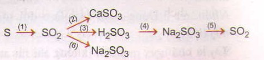
Bài giải
(1) S + O2 → SO2
(2) SO2 + CaO → CaSO3
(3) SO2 + H2O → H2SO3
(4) H2SO3 + Na2O → Na2SO4 + H2O
(5) Na2SO3 + H2SO4 → Na2SO4 + SO2 + H2O
(6) SO2 + 2NaOH → Na2SO3 + H2O
Bài 2: Hãy nhận biết từng chất trong mỗi nhóm chất sau bằng phương pháp hóa học
a) Hai chất rắn màu trắng là CaO và P2O5
b) Hai chất khí không màu là SO2 và O2
Viết các phương trình hóa học.
Bài giải:
a) Cho nước vào hai ống nghiệm có chứa CaO và P2O5. Sau đó cho quỳ tím vào mỗi dung dịch:
- dung dịch nào làm đổi màu quỳ tím thành xanh là dung dịch bazơ, chất ban đầu là CaO.
- dung dịch nào làm đổi màu quỳ tím thành đỏ là dung dịch axit, chất ban đầu là P2O5
CaO + H2O → Ca(OH)2
P2O5 + 3H2O → 2H3PO4
b) Dẫn lần lượt từng khí vào dung dịch nước vôi trong, nếu có kết tủa xuất hiện thì khí dẫn vào là SO2
SO2 + Ca(OH)2 → CaSO3 + H2O
Nếu không có hiện tượng gì thì khí dẫn vào là khí O2. Để xác định là khí O2 ta dùng que đóm còn than hồng, que đóm sẽ bùng cháy trong khí oxi.
3. Có những khí ẩm (khí có lần hơi nước): cacbon đioxit, hiđro, oxi, lưu huỳnh đioxit. Khí nào có thể được làm khô bằng canxi oxit ? Giải thích.
Bài giải:
Làm khô một chất là loại nước ra khỏi chất đó nhưng không làm chất đó biến thành chất khác.
Như vậy CaO chỉ làm khô những chất không có phản ứng hóa học với CaO, đó là các chất H2, O2. Những chất không làm khô bằng CaO là CO2 và SO2, vì có phản ứng với CaO:
CaO + SO2 → CaSO3
CaO + CO2 → CaCO3
5. Khí lưu huỳnh đioxit được tạo thành từ cặp chất nào sau đây ?
a) K2SO3 và H2SO4. b) K2SO4 và HCl. c) Na2SO3 và NaOH
d) Na2SO4 và CuCl2. e) Na2SO3 và NaCl.
Viết phương trình hóa học.
Bài giải:
Trong các cặp chất cho, SO2 chỉ tạo ra từ cặp chất K2SO3 và H2SO4, vì có phản ứng sinh ra SO2:
K2SO3 + H2SO4 → K2SO4 + SO2 + H2O

moclan26
- Bài viết : 56
Danh vọng : 5951
Đến từ : Thanh Hóa
 Re: Giải bài tập hóa 9
Re: Giải bài tập hóa 9
Tính chất hóa học của axit
1. Từ Mg, MgO, Mg(OH)2 và dung dịch axit sunfuric loãng, hãy viết các phương trình hóa học của phản ứng điều chế magie sunfat.Bài giải:
Mg + H2SO4 → MgSO4 + H2
MgO + H2SO4 → MgSO4 + H2O
Mg(OH)2 + H2SO4 → MgSO4 + 2H2O
2. Có những chất sau: CuO, Mg, Al2O3, Fe(OH)3, Fe2O3. Hãy chọn một trong những chất đã cho tác dụng với dung dịch HCl sinh ra:
a) Khí nhẹ hơn không khí và cháy được trong không khí.
b) Dung dịch có màu xanh lam
c) Dung dịch có màu vàng nâu
d) Dung dịch không có màu.
Viết các phương trình hóa học.
Bài giải:
a) Khí nhẹ hơn không khí và cháy được trong không khí là khí H2;
Mg + 2HCl → MgCl2 + H2
b) Dung dịch có màu xanh lam là dung dịch muối đồng (II).
CuO + 2HCl → CuCl2 + H2O
c) Dung dịch có màu vàng nâu là dung dịch muối sắt (III)
Fe(OH)3 + 3HCl → FeCl3 + 3H2O
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
d) Dung dịch không có màu là dung dịch muối nhôm.
Al2O3 + 6HCl → 2AlCl3 + 3H2O.
3. Hãy viết các phương trình hóa học của phản ứng trong mỗi trường hợp sau:
a) Magie oxit và axit nitric; d) Sắt và axit clohiđric;
b) Đồng (II) oxit và axit clohiđric; e) Kẽm và axit sunfuric loãng.
c) Nhôm oxit và axit sunfuric;
Bài giải:
a) MgO + 2HNO3 → Mg(NO3)2 + H2O
b) CuO + 2HCl → CuCl2 + H2O
c) Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
d) Fe + 2HCl → FeCl2 + H2
e) Zn + H2SO4 → ZnSO4 + H2
4. Có 10 gam hỗn hợp bột hai kim loại đồng và sắt. Hãy giới thiệu phương pháp xác định thành phần phần trăm (theo khối lượng) của mỗi kim loại trong hỗn hợp theo:
a) Phương pháp hóa học. Viết phương trình hóa học.
b) Phương pháp vật lí.
(Biết rằng đồng không tác dụng với axit HCl và axit H2SO4 loãng)
Bài giải:
a) Phương pháp vật lí: Dùng thanh nam châm, sau khi đã bọc đầu nam châm bằng mảnh nilon mỏng và nhỏ. Chà nhiều lần vào hỗn hợp để lấy riêng Fe ra (Vì sắt bị nam châm hút còn đồng không bị nam châm hút), rồi đem cân. Giả sử có m gam Fe. Thành phần phần trăm theo khối lượng của sắt là:
%Fe =
Suy ra: %Cu = 100% - %Fe
b) Phương pháp hóa học: Ngâm hỗn hợp bột Fe và Cu vào dung dịch axit HCl hoặc H2SO4 loãng , lấy dư cho đến khi khí ngừng thoát ra (Fe đã phản ứng hết), lọc lấy chất rắn còn lại, rửa nhiều lần trên giấy lọc, làm khô và cân. Chất rắn đó là Cu. Giả sử có m gam Cu. Thành phần phần trăm theo khối lượng của đồng là:
%Cu =
Suy ra: %Fe = 100% - %Cu
Một số axit quan trọng
1. Có những chất: CuO, BaCl2 Zn, ZnO. Chất nào nói trên tác dụng với dung dịch HCl, dung dịch H2SO4 loãng sinh ra:
a) chất khí cháy được trong không khí ?
b) Dung dịch có màu xanh lam /
c) chất kết tủa màu trắng không tan trong nước và axit ?
d) dung dịch không màu và nước ?
Viết tất cả các phương trình hóa học.
Bài giải:
a) Khí cháy được trong không khí là hiđro
Zn + 2HCl → ZnCl2 + H2
Zn + H2SO4 → ZnSO4 + H2
b) Dung dịch có màu xanh lam là dung dịch muối đồng (II)
CuO + 2HCl → CuCl2 + H2O
CuO + H2SO4 → CuSO4 + H2O
c) Chất kết tủa trắng không tan trong nước và axit là BaSO4
BaCl2 + H2SO4 → 2HCl + BaSO4
d) Dung dịch không màu là muối kẽm.
ZnO + 2HCl → ZnCl2 + H2O
ZnO + H2SO4 → ZnSO4 + H2O
3. Bằng cách nào có thể nhận biết được từng chất trong mỗi cặp chất sau theo phương pháp hóa học ?
a) Dung dịch HCl và dung dịch H2SO4
b) Dung dịch NaCl và dung dịch Na2SO4
c) Dung dịch Na2SO4 và H2SO4
Viết phương trình hóa học
Bài giải:
a) Cho dung dịch muối bari hoặc Ba(OH)2, thí dụ BaCl2 vào hai ống nghiệm, mỗi ống chứa sẵn dung dichj HCl và H2SO4
Ở ống nghiệm nào xuất hiện kết tủa thì dung dịch chứa ban đầu là dung dịch H2SO4; ở ống nghiệm không thấy hiện tượng gì thì dung dịch chứa ban đầu là dung dịch HCl
BaCl2 + H2SO4 → 2HCl + BaSO4
b) Dùng thuốc thử như câu a) thấy kết tủa là dung dịch Na2SO4 không có kết tủa là dung dịch NaCl
BaCl2 + Na2SO4 → 2NaCl + BaSO4 c) Có nhiều cách để nhận biết 2 dung dịch Na2SO4 và H2SO4 đơn giản nhất là dùng quỳ tím.
Cho quỳ tím vào từng dung dịch: dung dịch làm quỳ tím đối sang màu đỏ là dung dich H2SO4, dung dịch không làm đổi màu quỳ tím là dung dịch muối Na2SO4.
5. Hãy sử dụng những chất có sẵn: Cu, Fe, KOH, C6H12O6 (glucozơ), dung dịch H2SO4 loãng, H2SO4 đặc và những dụng cụ thí nghiệm cần thiết để làm những thí nghiệm chứng minh rằng:
a) Dung dịch H2SO4 loãng có những tính chất hóa học của axit
b) H2SO4 đặc có những tính chất hóa học riêng
Viết phương trình hóa học cho mỗi thí nghiệm.
Bài giải:
a) Để chứng minh dung dịch H2SO4 loãng có những tính chất hóa học của axit, ta thực hiện các thí nghiệm:
Cho axit H2SO4 loãng lần lượt phản ứng với Fe, CuO, KOH:
Fe + H2SO4 → FeSO4 + H2 (có khí thoát ra)
(kim loại Cu không tác dụng với dd H2SO4 loãng)
CuO + H2SO4 → H2O + CuSO4 (dung dịch có màu xanh lam)
2KOH + H2SO4 → K2SO4 + H2O
(Cho quỳ tím vào dung dịch KOH, dung dịch có màu xanh. Rót từ từ dung dịch H2SO4 thấy màu xanh dần biến mất đến khi dung dịch không màu)
b) Để chứng minh dung dịch H2SO4 đặc có những tính chất hóa học riêng ta thực hiện các thí nghiệm:
Cho axit H2SO4 đặc tác dụng với Cu đun nóng và với glucozơ:
Cu + H2SO4 đ, nóng → CuSO4 + SO2 + H2O
(Đồng bị hòa tan dần, dung dịch chuyển sang màu xanh và có khí mùi hắc thoát ra)
C12H22O11 12C + 11H2O
12C + 11H2O
(Đường bị hóa thành than và đẩy lên khỏi cốc)
6. Cho một khối lượng mạt sắt dư vào 50 ml dung dịch HCl. Phản ứng xong, thu được 3,36 lít khí (đktc).
a) Viết phương trình hóa học;
b) Tính khối lượng mạt sắt đã tham gia phản ứng
c) Tìm nồng độ mol của dung dịch HCl đã dùng.
Bài giải:
a) Số mol khí H2 = 3,36 : 22,4 = 0,15 mol
a) Phương trình phản ứng:
Fe + 2HCl → FeCl2 + H2
Phản ứng 0,15 0,3 0,15 ← 0,15 (mol)
b) Khối lượng sắt đã phản ứng:
mFe = 0,15 . 56 = 8,4 g
c) Số mol HCl phản ứng:
nHCl = 0,3 mol; 50 ml = 0,05 lít
Nồng độ mol của dung dịch HCl: CM,HCl = = 6M
= 6M
7. Hòa tan hoàn toàn 12,2 gam hỗn hợp bột CuO và ZnO cần 100 ml dung dịch HCl 3M.
a) Viết các phương trình hóa học.
b) Tính phần trăm theo khối lượng của mỗi oxit trong hỗn hợp ban đầu.
c) Hãy tính khối lượng dung dịch H2SO4 nồng độ 20% để hòa tan hoàn toàn hỗn hợp các oxit trên.
Bài giải:
Số mol HCl = 3 . = 0,3 mol
= 0,3 mol
Gọi x, y là số mol của CuO và ZnO
a) Các phương trinh hóa học:
CuO + 2HCl → CuCl2 + H2O
Phản ứng x → 2x x (mol)
ZnO + 2HCl → ZnCl2 + H2O
Phản ứng: y → 2y y (mol)
b) Từ khối lượng của hỗn hợp và số mol HCl, ta lập hệ phương trình.

Giải (1)(2) ta được x = 0,05 mol = số mol CuO; y = 0,1 mol = số mol ZnO
%CuO = . 100% =
. 100% =  = 33%
= 33%
c) Vì CuO và ZnO phản ứng với H2SO4 theo cùng tỉ lệ mol, nên có thể coi hai oxit như một oxit có công thức chung là MO với số mol = x + y = 0,15 mol
MO + H2SO4 → MSO4 + H2O
Phản ứng: 0,15 → 0,15 0,15 (mol)
m H2SO4 = 0,15 . 98 = 14,7 g
m dd H2SO4 20% = = 73,5 g
= 73,5 g
a) chất khí cháy được trong không khí ?
b) Dung dịch có màu xanh lam /
c) chất kết tủa màu trắng không tan trong nước và axit ?
d) dung dịch không màu và nước ?
Viết tất cả các phương trình hóa học.
Bài giải:
a) Khí cháy được trong không khí là hiđro
Zn + 2HCl → ZnCl2 + H2
Zn + H2SO4 → ZnSO4 + H2
b) Dung dịch có màu xanh lam là dung dịch muối đồng (II)
CuO + 2HCl → CuCl2 + H2O
CuO + H2SO4 → CuSO4 + H2O
c) Chất kết tủa trắng không tan trong nước và axit là BaSO4
BaCl2 + H2SO4 → 2HCl + BaSO4
d) Dung dịch không màu là muối kẽm.
ZnO + 2HCl → ZnCl2 + H2O
ZnO + H2SO4 → ZnSO4 + H2O
3. Bằng cách nào có thể nhận biết được từng chất trong mỗi cặp chất sau theo phương pháp hóa học ?
a) Dung dịch HCl và dung dịch H2SO4
b) Dung dịch NaCl và dung dịch Na2SO4
c) Dung dịch Na2SO4 và H2SO4
Viết phương trình hóa học
Bài giải:
a) Cho dung dịch muối bari hoặc Ba(OH)2, thí dụ BaCl2 vào hai ống nghiệm, mỗi ống chứa sẵn dung dichj HCl và H2SO4
Ở ống nghiệm nào xuất hiện kết tủa thì dung dịch chứa ban đầu là dung dịch H2SO4; ở ống nghiệm không thấy hiện tượng gì thì dung dịch chứa ban đầu là dung dịch HCl
BaCl2 + H2SO4 → 2HCl + BaSO4
b) Dùng thuốc thử như câu a) thấy kết tủa là dung dịch Na2SO4 không có kết tủa là dung dịch NaCl
BaCl2 + Na2SO4 → 2NaCl + BaSO4 c) Có nhiều cách để nhận biết 2 dung dịch Na2SO4 và H2SO4 đơn giản nhất là dùng quỳ tím.
Cho quỳ tím vào từng dung dịch: dung dịch làm quỳ tím đối sang màu đỏ là dung dich H2SO4, dung dịch không làm đổi màu quỳ tím là dung dịch muối Na2SO4.
5. Hãy sử dụng những chất có sẵn: Cu, Fe, KOH, C6H12O6 (glucozơ), dung dịch H2SO4 loãng, H2SO4 đặc và những dụng cụ thí nghiệm cần thiết để làm những thí nghiệm chứng minh rằng:
a) Dung dịch H2SO4 loãng có những tính chất hóa học của axit
b) H2SO4 đặc có những tính chất hóa học riêng
Viết phương trình hóa học cho mỗi thí nghiệm.
Bài giải:
a) Để chứng minh dung dịch H2SO4 loãng có những tính chất hóa học của axit, ta thực hiện các thí nghiệm:
Cho axit H2SO4 loãng lần lượt phản ứng với Fe, CuO, KOH:
Fe + H2SO4 → FeSO4 + H2 (có khí thoát ra)
(kim loại Cu không tác dụng với dd H2SO4 loãng)
CuO + H2SO4 → H2O + CuSO4 (dung dịch có màu xanh lam)
2KOH + H2SO4 → K2SO4 + H2O
(Cho quỳ tím vào dung dịch KOH, dung dịch có màu xanh. Rót từ từ dung dịch H2SO4 thấy màu xanh dần biến mất đến khi dung dịch không màu)
b) Để chứng minh dung dịch H2SO4 đặc có những tính chất hóa học riêng ta thực hiện các thí nghiệm:
Cho axit H2SO4 đặc tác dụng với Cu đun nóng và với glucozơ:
Cu + H2SO4 đ, nóng → CuSO4 + SO2 + H2O
(Đồng bị hòa tan dần, dung dịch chuyển sang màu xanh và có khí mùi hắc thoát ra)
C12H22O11
(Đường bị hóa thành than và đẩy lên khỏi cốc)
6. Cho một khối lượng mạt sắt dư vào 50 ml dung dịch HCl. Phản ứng xong, thu được 3,36 lít khí (đktc).
a) Viết phương trình hóa học;
b) Tính khối lượng mạt sắt đã tham gia phản ứng
c) Tìm nồng độ mol của dung dịch HCl đã dùng.
Bài giải:
a) Số mol khí H2 = 3,36 : 22,4 = 0,15 mol
a) Phương trình phản ứng:
Fe + 2HCl → FeCl2 + H2
Phản ứng 0,15 0,3 0,15 ← 0,15 (mol)
b) Khối lượng sắt đã phản ứng:
mFe = 0,15 . 56 = 8,4 g
c) Số mol HCl phản ứng:
nHCl = 0,3 mol; 50 ml = 0,05 lít
Nồng độ mol của dung dịch HCl: CM,HCl =
7. Hòa tan hoàn toàn 12,2 gam hỗn hợp bột CuO và ZnO cần 100 ml dung dịch HCl 3M.
a) Viết các phương trình hóa học.
b) Tính phần trăm theo khối lượng của mỗi oxit trong hỗn hợp ban đầu.
c) Hãy tính khối lượng dung dịch H2SO4 nồng độ 20% để hòa tan hoàn toàn hỗn hợp các oxit trên.
Bài giải:
Số mol HCl = 3 .
Gọi x, y là số mol của CuO và ZnO
a) Các phương trinh hóa học:
CuO + 2HCl → CuCl2 + H2O
Phản ứng x → 2x x (mol)
ZnO + 2HCl → ZnCl2 + H2O
Phản ứng: y → 2y y (mol)
b) Từ khối lượng của hỗn hợp và số mol HCl, ta lập hệ phương trình.
Giải (1)(2) ta được x = 0,05 mol = số mol CuO; y = 0,1 mol = số mol ZnO
%CuO =
c) Vì CuO và ZnO phản ứng với H2SO4 theo cùng tỉ lệ mol, nên có thể coi hai oxit như một oxit có công thức chung là MO với số mol = x + y = 0,15 mol
MO + H2SO4 → MSO4 + H2O
Phản ứng: 0,15 → 0,15 0,15 (mol)
m H2SO4 = 0,15 . 98 = 14,7 g
m dd H2SO4 20% =

moclan26
- Bài viết : 56
Danh vọng : 5951
Đến từ : Thanh Hóa
 Re: Giải bài tập hóa 9
Re: Giải bài tập hóa 9
Một số bazơ quan trọng
1. Có 3 lọ không nhãn, mỗi lọ đựng chất rắn sau: NaOH, Ba(OH)2, NaCl. Hãy trình bày cách nhận biết chất đựng trong mỗi lọ bằng phương pháp hóa học. Viết các phương trình hóa học (nếu có).Lời giải.
Hòa tan mẫu thử từng chất vào nước để tạo thành các dung dịch tương ứng. Cho quỳ tím vào mỗi dung dịch: Nếu quỳ tím chuyển sang màu xanh là NaOH và Ba(OH)2, nếu quỳ tím không đổi màu là NaCl.Dẫn khí CO2 vào hai dung dịch baz ơ còn lại: Nếu có kết tủa xuất hiện là Ba(OH)2 nếu không kết tủa là NaOH.
Ba(OH)2 + CO2 → BaCO3↓ + H2O
2NaOH + CO2 → Na2CO3 + H2O
2. Có những chất sau: Zn, Zn(OH)2, NaOH, Fe(OH)3, CuSO4, NaCl, HCl.
Hãy chọn chất thích hợp điền vào mỗi sơ đồ phản ứng sau và lập phương trình học:
a) …..
b) H2SO4 + … → Na2SO4 + H2O;
c) H2SO4 + … → ZnSO4 + H2O;
d) NaOH + …. → NaCl + H2O;
e) ….. + CO2 → Na2CO3 + H2O.
Lời giải.
a) Fe(OH)3 b) H2SO4 + NaOH → Na2SO4 + H2O;
c) H2SO4 + Zn(OH)2 → ZnSO4 + H2O;
d) NaOH + HCl → NaCl + H2O;
e) 2NaOH + CO2 → Na2CO3 + H2O
3. Dẫn từ từ 1,568 lít khí CO2 (đktc) vào một dung dịch có hòa tan 6,4 gam NaOH, sản phẩm là muối Na2CO3.
a) Chất nào đã lấy dư và dư là bao nhiêu (lít hoặc gam)?
b) Hãy xác định khối lượng muối thu được sau phản ứng.
Lời gải.
Số mol: nCO2 = Phương trình hóa học:
2NaOH + CO2 → Na2CO3 + H2O
Lúc ban đầu: 0,07 0,16 0 (mol)
Phản ứng: 0,07 → 0,14 0,07
Sau phản ứng: 0 0,02 0,07
a)Chất còn dư là NaOH và dư: 0,02x40 = 0,8 g
b)Khối lượng muối Na2CO3 tạo thành là: 0,07x106 = 7,42 g.
Một số bazơ quan trọng(tiếp)
1. Viết các phương trình hóa học thực hiện những chuyển đổi hóa hoặc sau:
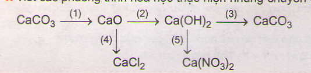
Lời giải.
(1) CaCO3 CaO + CO2(2) CaO + H2O → CaO(OH)2
(3) Ca(OH)2 + CO2 → CaCO3 + H2O
(4) CaO + 2HCl → CaCl2 + H2O
(5) Ca(OH)2 + 2HNO3 → Ca(NO3)2 + 2H2O
3. Hãy viết các phương trình hóa học của phản ứng khi cho dung dịch NaOH tác dụng với dung dịch H2SO4 tạo ra:
a) Muối natri hiđrosunfat. B) Muối natrisunfat.
Lời giải.
a) H2SO4 + NạOH → H2O + NaHSO4b) H2SO4 + 2NaOH → 2H2O + Na2SO4
4. Một dung dịch bão hòa khí CO2 trong nước có pH = 4. Hãy giải thích và viết phương trình hóa học của CO2 với nước.
Lời giải.
Dung dịch bão hòa CO2 có pH = 4, nghĩa là dung dịch có tính axit yếu. Vì khí CO2 tác dụng với nước tạo thành axit cacbonic, là một axit rất yếu:CO2 + H2O → H2CO3

moclan26
- Bài viết : 56
Danh vọng : 5951
Đến từ : Thanh Hóa
 Re: Giải bài tập hóa 9
Re: Giải bài tập hóa 9
Tính chất hóa học của muối
1. Hãy dẫn ra một dung dịch muối khi tác dụng với một dung dịch chất khác thì tạo ra:a) Chất khí; b) Chất kết tủa.
Viết phương trình hóa học.
Lời giải.
a) Ta chọn các muối cacbonat hoặc muối sunfit tác dụng với axit mạnh.Thí dụ: CaCO3 + HCl → CaCl2 + CO2↑ + H2O
Na2SO3 + H2SO4 → Na2SO4 + SO2↑ + H2O
b) Ta dựa vào bảng tính tan của muối để chọn các muối không tan (BaSO4, AgCl, BaCO3…) hoặc baz ơ không tan, từ đó tìm ra muối và chất tham gia phản ứng còn lại, thí dụ:
BaCl2 + H2SO4 → 2HCl + BaSO4↓
Na2CO3 + Ba(NO3)2 → 2NaNO3 + BaCO3↓
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4↓
3. Có những dung dịch muối sau: Mg(NO3)2, CuCl2. Hãy cho biết muối nào có thể tác dụng với:
a) Dung dịch NaOH; b) Dung dịch HCl; c) Dung dịch AgNO3.
Nếu có phản ứng, hãy viết các phương trình hóa học.
Lời giải.
a) Cả hai muối tác dụng với dung dịch NaOH vì sản phẩm tạo thành có Mg(OH)2, Cu(OH)2 không tan,
Mg(NO3)2 + 2NaOH → 2NaNO3 + Mg(OH)2↓
CuCl2 + 2NaOH → NaCl + Cu(OH)2↓
b) Không có muối nào tác dụng với dung dịch HCl vì không có chất kết tủa hay chất khí tạo thành.
c) Chỉ có muối CuCl2 tác dụng với dung dịch AgNO3 vì sản phẩm tạo thành có AgCl không tan.
CuCl2 + 2AgNO3 → 2AgCl↓ + Cu(NO3)2
4. Cho những dung dịch muối sau đây phản ứng với nhau từng đôi một, hãy ghi dấu (x) nếu có phản ứng, dấu (o) nếu không.

Viết phương trình hóa học ở ô có dấu (x).
Lời giải.
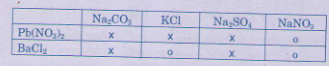
Phương trình hóa học của các phản ứng:
Pb(NO3)2 + Na2CO3 → 2NaNO3 + PbCO3↓
Pb(NO3)2 + 2KCl → 2KNO3 + PbCl2↓
Pb(NO3)2 + Na2SO4 → 2NaNO3 + PbSO4↓
BaCl2 + NaCO3 → 2NaCl + BaCO3↓
BaCl2 + Na2SO4 → 2NaCl + BaSO4↓
Luyện tập tính chất hóa học của oxit và axit
1. Có những oxit sau: SO2, CuO, Na2O, CO2. Hãy cho biết những oxit nào tác dụng được vớia) Nước
b) Axit clohiđric
c) Natri hiđroxit
Viết các phương trình hóa học.
Bài giải:
a) Những oxit tác dụng với nước là: SO2, Na2O, CO2
SO2 + H2O → H2SO3
Na2O + H2O → 2NaOH
CO2 + H2O → H2CO3
b) Những oxit tác dụng với HCl là CuO, Na2O
CuO + 2HCl → CuCl2 + H2O
Na2O + 2HCl → 2NaCl + H2O
c) Những oxit tác dụng với natri hiđroxit là SO2 và CO2
SO2 + 2NaOH → Na2SO3 + H2O
CO2 + 2NaOH → Na2CO3 + H2O
2. Những oxit nào dưới đây có thể điều chế bằng
a) phản ứng hóa hợp ? Viết phương trình hóa học
b) phản ứng hóa hợp và phản ứng phân hủy ? viết phương trình hóa học.
(1) H2O; (2) CuO; (3) Na2O; (4) CO2; (5) P2O5
Bài giải:
a) Cả 5 oxit đã cho đều có thể điều chế bằng phản ứng hóa hợp, vì các nguyên tố H, Cu, Na, P đều tác dụng được với oxi
2H2 + O2  2H2O
2H2O
2Cu + O2 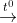 2CuO
2CuO
4Na + O2 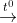 2Na2O
2Na2O
4P + 5O2 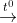 2P2O5
2P2O5
C + O2 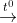 CO2
CO2
b) Các oxit CuO, CO2, H2O có thể được điều chế bằng phản ứng phân hủyThí dụ: Cu(OH)2
CaCO3
3. Khí CO được dùng làm chất đốt trong công nghiệp, có lẫn tạp chất là các khí SO2 và CO2. Làm thế nào có thể loại bỏ được những tạp chất ra khỏi CO bằng hóa chất rẻ tiền nhất ?
Viết các phương trình hóa học
Bài giải:
Để loại bỏ SO2 và CO2 ta dùng dung dịch bazơ. Dung dịch bazơ rẻ tiền nhất là dung dịch nước vôi trong Ca(OH)2. Dẫn hỗn hợp khí đi qua dung dịch Ca(OH)2 dư, toàn bộ SO2 và CO2 bị hấp thụ hết do có phản ứng:
CO2 + Ca(OH)2 → CaCO3 + H2O
SO2 + Ca(OH)2 → CaSO3 + H2O
Khí CO không phản ưng, thoát ra và được thu lấy.
Một số muối quan trọng
1. Có những muối sau: CaCO3, CaSO4, Pb(NO3)2, NaCl. Muối nào nói trên:
a) Không được phép có trong nước ăn vì tính độc hại của nó?
b) Không độc nhưng cũng không nên có trong nước ăn vì vị mặn của nó?
c) Không tan trong nước, nhưng bị phân hủy ở nhiệt độ cao?
d) Rất ít tan trong nước và khó bị phân hủy ở nhiệt độ cao?
Lời giải.
a) Pb(NO3)2 b) NaCl c)CaCO3 d) CaSO4
2. Hai dung dịch tác dụng với nhau, sản phẩm thu được có NaCl. Hãy cho biết hai dung dịch chất ban đầu có thể là những chất nào. Minh họa bằng các phương trình hóa học.
Lời giải.
Từ dung dịch ban đầu, phản ứng có sinh ra muối NaCl, suy ra một dung dịch phải là dung dịch của hợp chất có chứa Na, dung dịch còn lại là dung dịch của hợp chất có chứa Cl; Mặt khác, vì NaCl tan nên sản phẩm còn lại phảo là hợp chất không tan, chất khí hay H2O, thí dụ:
NaOH + HCl → NaCl + H2O
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
BaCl2 + NaSO4 → 2NaCl + BaSO4↓
CuCl2 + 2NaOH → 2NaCl + Cu(OH)2↓
3) a) Viết phương trình điện phân dung dịch muối ăn (có màng ngăn).
b) Những sản phẩm của sự điện phân dung dịch NaCl ở trên có nhiều ứng dụng quan trọng:
-Khí clo dùng để: 1)…, 2)…, 3)…
-Khí hidro dùng để:1)…, 2)…, 3)…
-Natri hiđroxit dùng để: 1)…, 2)…, 3)…
Điền những ứng dụng sau đây vào những chỗ để trống ở trên cho phù hợp:
Tẩy trắng vải, giấy; nấu xà phòng; sản xuất axit clohi đric; chế tạo hóa chất trừ sâu, diệt cỏ dại; hàn cắt kim loại; sát trùng, diệt khuẩn nước ăn; nhiên liệu cho động cơ tên lửa; bơm khí cầu, bong thám không; sản xuất nhôm, sản xuất chất dẻo PVC; chế biến dầu mỏ.
Lời giải.
a) Phương trình điện phân dung dịch NaCl (có màng ngăn):
2NaCl + 2H2O 2NaOH + H2↑ + Cl2↑
2NaOH + H2↑ + Cl2↑
b)- Khí clo dùng để: 1) Tẩy trắng vải, giấy; sát trùng, diệt khuẩn nước ăn; 2) sản xuất axit HCl; 3) sản xuất chất dẻo PVC, chất trừ sâu, diệt cỏ dại.
- Khí hidro dùng để: 1) hàn cắt kim loại; 2) làm nhiên liệu cho động cơ tên lửa; 3) bơm khí cầu, bóng thám không.
- Natri hiđroxit dùng để: 1) nấu xà phòng; 2) sản xuất nhôm; 3) chế biến dầu mỏ.
4. Dung dịch NaOH có thể dùng để phân biệt 2 muối có trong mỗi cặp chất sau được không? (nếu được thì ghi dấu (x), Nếu không thì ghi dấu (o) vào các ô vuông).
a) Dung dịch K2SO4 và dung dịch Fe2(SO4)3.
b) Dung dịch Na2SO4 và dung dịch CuSO4.
c) Dung dịch NaCl và dung dịch BaCl2.
Viết các phương trình hóa học, nếu có.
Lời giải.
Các phương trình hóa học:
Fe2(SO4)3 + 6NaOH → 3Na2SO4 + 2Fe(OH)3↓
CuCl2 + 2NaOH → 2NaCl + Cu(OH)2↓
(Những dung dịch K2SO4, Na2SO4, NaCl, BaCl2 đều không phản ứng với dung dịch NaOH).
5. Trong phòng thí nghiệm có thể dùng những muối KClO3 hoặc KNO3 để điều chế khí oxi bằng phản ứng phân hủy.
a) Viết các phương trình hóa học đối xới mỗi chất.
b) Nếu dùng 0,1 mol mỗi chất thì thể tích khí oxi thu được có khác nhau hay không? Hãy tính thể tích khí oxi thu được.
c) Cần điều chế 1,12 lít khí oxi, hãy tính khối lượng mỗi chất cần dùng.
Các thể tích khí được đo ở điều kiện tiêu chuẩn.
Lời giải.
a) Các phương trình phản ứng
2KNO3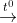 2KNO2 + O2↑ (1)
2KNO2 + O2↑ (1)
2KClO3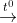 2KCl + 3O2↑ (2)
2KCl + 3O2↑ (2)
b) Theo (1) và (2), thấy số mol hai muối tham gia phản ứng như nhau nhưng số mol oxi tạo thành khác nhau và do đó thể tích khí oxi thu được là khác nhau.
Theo (1): nO2 = nKNO3 =
nKNO3 = 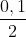 = 0,05 mol; VO2 = 0,05x22,4 = 1,12 lít
= 0,05 mol; VO2 = 0,05x22,4 = 1,12 lít
Theo (2): nO2 = nKClO3 =
nKClO3 = 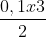 = 0,15 mol; VO2 = 0,15x22,4 = 3,36 lít
= 0,15 mol; VO2 = 0,15x22,4 = 3,36 lít
c) Để thu được 1,12 lít khí (0,05 mol) O2, thì:
Theo (1): nKNO3 = 2nO2 = = 0,1 mol; mKNO3 = 0,1x101 = 10,1 g
Theo (2): nKClO3 = nO2 =
nO2 =  x0,05 mol; VKClO3 =
x0,05 mol; VKClO3 =  x0,05x122,5 = 4,086 g.
x0,05x122,5 = 4,086 g.
a) Không được phép có trong nước ăn vì tính độc hại của nó?
b) Không độc nhưng cũng không nên có trong nước ăn vì vị mặn của nó?
c) Không tan trong nước, nhưng bị phân hủy ở nhiệt độ cao?
d) Rất ít tan trong nước và khó bị phân hủy ở nhiệt độ cao?
Lời giải.
a) Pb(NO3)2 b) NaCl c)CaCO3 d) CaSO4
2. Hai dung dịch tác dụng với nhau, sản phẩm thu được có NaCl. Hãy cho biết hai dung dịch chất ban đầu có thể là những chất nào. Minh họa bằng các phương trình hóa học.
Lời giải.
Từ dung dịch ban đầu, phản ứng có sinh ra muối NaCl, suy ra một dung dịch phải là dung dịch của hợp chất có chứa Na, dung dịch còn lại là dung dịch của hợp chất có chứa Cl; Mặt khác, vì NaCl tan nên sản phẩm còn lại phảo là hợp chất không tan, chất khí hay H2O, thí dụ:
NaOH + HCl → NaCl + H2O
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
BaCl2 + NaSO4 → 2NaCl + BaSO4↓
CuCl2 + 2NaOH → 2NaCl + Cu(OH)2↓
3) a) Viết phương trình điện phân dung dịch muối ăn (có màng ngăn).
b) Những sản phẩm của sự điện phân dung dịch NaCl ở trên có nhiều ứng dụng quan trọng:
-Khí clo dùng để: 1)…, 2)…, 3)…
-Khí hidro dùng để:1)…, 2)…, 3)…
-Natri hiđroxit dùng để: 1)…, 2)…, 3)…
Điền những ứng dụng sau đây vào những chỗ để trống ở trên cho phù hợp:
Tẩy trắng vải, giấy; nấu xà phòng; sản xuất axit clohi đric; chế tạo hóa chất trừ sâu, diệt cỏ dại; hàn cắt kim loại; sát trùng, diệt khuẩn nước ăn; nhiên liệu cho động cơ tên lửa; bơm khí cầu, bong thám không; sản xuất nhôm, sản xuất chất dẻo PVC; chế biến dầu mỏ.
Lời giải.
a) Phương trình điện phân dung dịch NaCl (có màng ngăn):
2NaCl + 2H2O
 2NaOH + H2↑ + Cl2↑
2NaOH + H2↑ + Cl2↑b)- Khí clo dùng để: 1) Tẩy trắng vải, giấy; sát trùng, diệt khuẩn nước ăn; 2) sản xuất axit HCl; 3) sản xuất chất dẻo PVC, chất trừ sâu, diệt cỏ dại.
- Khí hidro dùng để: 1) hàn cắt kim loại; 2) làm nhiên liệu cho động cơ tên lửa; 3) bơm khí cầu, bóng thám không.
- Natri hiđroxit dùng để: 1) nấu xà phòng; 2) sản xuất nhôm; 3) chế biến dầu mỏ.
4. Dung dịch NaOH có thể dùng để phân biệt 2 muối có trong mỗi cặp chất sau được không? (nếu được thì ghi dấu (x), Nếu không thì ghi dấu (o) vào các ô vuông).
a) Dung dịch K2SO4 và dung dịch Fe2(SO4)3.
b) Dung dịch Na2SO4 và dung dịch CuSO4.
c) Dung dịch NaCl và dung dịch BaCl2.
Viết các phương trình hóa học, nếu có.
Lời giải.
Các phương trình hóa học:
Fe2(SO4)3 + 6NaOH → 3Na2SO4 + 2Fe(OH)3↓
CuCl2 + 2NaOH → 2NaCl + Cu(OH)2↓
(Những dung dịch K2SO4, Na2SO4, NaCl, BaCl2 đều không phản ứng với dung dịch NaOH).
5. Trong phòng thí nghiệm có thể dùng những muối KClO3 hoặc KNO3 để điều chế khí oxi bằng phản ứng phân hủy.
a) Viết các phương trình hóa học đối xới mỗi chất.
b) Nếu dùng 0,1 mol mỗi chất thì thể tích khí oxi thu được có khác nhau hay không? Hãy tính thể tích khí oxi thu được.
c) Cần điều chế 1,12 lít khí oxi, hãy tính khối lượng mỗi chất cần dùng.
Các thể tích khí được đo ở điều kiện tiêu chuẩn.
Lời giải.
a) Các phương trình phản ứng
2KNO3
2KClO3
b) Theo (1) và (2), thấy số mol hai muối tham gia phản ứng như nhau nhưng số mol oxi tạo thành khác nhau và do đó thể tích khí oxi thu được là khác nhau.
Theo (1): nO2 =
Theo (2): nO2 =
c) Để thu được 1,12 lít khí (0,05 mol) O2, thì:
Theo (1): nKNO3 = 2nO2 = = 0,1 mol; mKNO3 = 0,1x101 = 10,1 g
Theo (2): nKClO3 =

moclan26
- Bài viết : 56
Danh vọng : 5951
Đến từ : Thanh Hóa
 Re: Giải bài tập hóa 9
Re: Giải bài tập hóa 9
Phân bón hóa học
1. Có những loại phân bón hóa học: KCl, NH4NO3, NH4Cl, (NH4)2SO4, Ca3(PO4)2, Ca(H2PO4)2, (NH4)2HPO4, KNO3.a) Hãy cho biết tên hóa học của những phân bón nói trên.
b) Hãy sắp xếp những phân bón này thành 2 nhóm phân bón đơn và phân bón kép.
c) Trộn những phân bón nào với nhau ta được phân bón kép NPK?
Lời giải.
a) Tên hóa học của phân bón:

b) Nhóm phân bón dạng đơn: KCl, NH4NO3, NH4Cl, (NH4)2SO4, Ca3(PO4)2, Ca(H2PO4)2.
Nhóm phân bón dạng kép: NH4H2PO4, KNO3.
c) Để có phân bón kép NPK ta trộn các phan bón MH4NO3, NH4H2PO4 và KCl theo tỉ lệ thích hợp.
2*. Có 3 mẫu phân bón hóa học không ghi nhãn là: pân kali KCl, phân đạm NH4NO3 và phân supephotphat (phân lân) Ca(H2PO4)2. Hãy nhận biết mỗi mẫu phân bón trên bằng phương pháp hóa học.
Lời giải.
Dùng dung dịch Ca(OH)2 làm thuốc thử để nhận biết.
Cho dung dịch Ca(OH)2 vào mẫu thử của dung dịch các loại phân bón trên và đun nhẹ:
- Nếu có khí mùi khai NH3 thoát ra là NH4NO3
2NH4NO3 + Ca(OH)2
- Nếu có kết tủa xuất hiện là Ca(H2PO4)2
2Ca(OH)2 + Ca(H2PO4)2 → Ca3(PO4)2↓ + H2O
- Không có hiện tượng gì là KCl.
3. Một người làm vườn đã dùng 500 g (NH4)2SO4 để bón rau.
a) Nguyên tố dinh dưỡng nào có trong loại phân bón này?
b) Tính thành phần phần trăm của nguyên tố dinh dưỡng trong phân bón.
c) Tính khối lượng của nguyên tố dinh dưỡng bón cho ruộng rau.
Lời giải.
a) Nguyên tố dinh dưỡng cho cây trồng trong phân bón (NH4)2SO4 là nitơ.
b) M(NH4)2SO4 = 132 g; mN = 2x14 = 28 g.
%N =
c) mN = 500x
Mối quan hệ giữa các loại chất vô cơ
1. Chất nào trong những thuốc thử sau đây có thể dùng để phân biệt dung dịch natri sunfat và dung dịch natri cacbonat?a) Dung dịch bải clorua.
b) Dung dịch axit clohiđric.
c) Dung dịch chì nitrat.
d) Dung dịch bạc nitrat.
e) Dung dịch natri hiđroxit.
Lời giải.
Thuốc thử phải chọn sao cho khi cho vào Na2SO4 và Na2CO3 phải gây ra hiện tượng khác biệt, dễ nhận thấy.
- Không dùng BaCl2 và Pb(NO3)2 vì đều xảy ra phản ứng và tạo kết tủa có màu giống nhau.
- Không dùng AgNO3, vì đều xảy ra phản ứng, hiện tượng không khác nhau rõ rệt; Ag2CO3 không tan, Ag2SO4 ít tan và có màu giống nhau.
- Không dùng NaOH, vì đều không phản ứng, không có hiện tượng gì. Thuốc thử dùng được là dung dịch HCl ví HCl tác dụng với Na2CO3 có xuất hiện bọt khí và không tác dụng với Na2SO4.
2HCl + Na2CO3 → 2NaCl + CO2↑ H2O.
2. a) Cho các dung dịch sau đây lần lượt phản ứng với nhau từng đôi một, hãy ghi dấu (x) nếu có phản ứng xảy ra, số 0 nếu không có phản ứng.

b) Viết các phương trình hóa học (nếu có).
Hướng dẫn.
a) Phản ứng giữa các dung dịch trên đều thuộc loại phản ứng trao đổi, muốn xảy ra được sản phẩm phải có chất không tan, chất khí hoặc H2O.
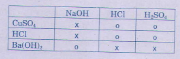
b) Các phương trình hóa học:
CuSO4 + 2NaOH → Na2SO4 + Cu(OH)2↓
HCl + NaOH → NaCl + H2O
Ba(OH)2 + 2HCl → BaCl2 + 2H2O
Ba(OH)2 + H2SO4 → Ba2SO4↓ + 2H2O
3. Viết phương trình hóa học cho những chuyển đổi hóa học sau:
a)
 b)
b) 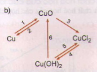
Lời giải.
a) (1) Fe2(SO4)3 + 3BaCl2 → 2FeCl3 + 3BaSO4↓
(2) FeCl3 + 3NaOH → 3NaCl + Fe(OH)3↓
(3) Fe2(SO4)3 + 6NaOH → Na2SO4 + 2Fe(OH)3↓
(4) 2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O
(5) 2Fe(OH)3
(6) Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
b) (1) 2Cu + O2
(2) CuO + H2 → Cu+ H2O
(3) CuO + 2HCl → CuCl2 + H2O
(4) CuCl2 + 2NaOH → Cu(OH)2 ↓ + 2NaCl
(5) Cu(OH)2 + 2HCl → CuCl2 + 2H2O
(6) Cu(OH)2
4*. Có những chất: Na2O, Na, NaOH, Na2SO4, Na2CO3, NaCl.
a) Dựa vào mối quan hệ giữa các chất, hãy sắp xếp các chất trên thành một dãy chuyển đổi hóa học.
b) Viết các phương trình hóa học cho dãy chuyển đổi hóa học ở câu a.
Lời giải.
a) Dãy chuyển hóa trên có thể là:
Na
b) Các phương trình hóa học:
4Na + O2 → 2Na2O
Na2O + H2O → 2NaOH
2NaOH + CO2 → Na2CO3 + H2O
Na2CO3 + H2SO4 → Na2SO4 + CO2↑ + H2O
Na2CO3 + BaCl2 → 2NaCl + BaSO4↓
CHƯƠNG II: KIM LOẠI
Tính chất vật lí của kim loại
Bài 2. Hãy chọn những từ (cụm từ) thích hợp để điền vào chỗ trống trong các câu sau đây :
a) Kim loại vontam được dùng làm dây tóc bóng đèn điện là do có ............ cao.
b) Bạc, vàng được dùng làm ........... vì có ánh kim rất đẹp.
c) Nhôm được dùng làm vật liệu chế tạo vỏ máy bay là do ............. và ..........
d) Đồng và nhôm được dùng làm ............. là do dẫn điện tốt.
e ............. được dùng làm dụng cụ nấu bếp là do bền trong không khí và dẫn nhiệt tốt.
1. nhôm ; 2. bền ; 3. nhẹ ; 4. nhiệt độ nóng chảy ; 5. dây điện ; 6. đồ trang sức.
Lời giải:
a) nhiệt độ nóng chây
b) đồ trang sức
c) nhẹ, bền
d) dây diện
e) nhôm
Bài 4. Hãy tính thể tích 1 mol của mỗi kim loại (nhiệt độ, áp suất trong phòng thí nghiệm), biết khối lượng riêng (g/cm3) tương ứng là : Da/ = 2,7 ; DK = 0,86 ; DCu = 8,94.
Lời giải:
Thể tích mol là thể tích chiếm bởi M gam kim loại đó. Áp dụng công thức:
V =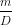 , với m = M gam.
, với m = M gam.
VAl =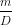 =
= 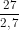 = 10cm3. ; Vk =
= 10cm3. ; Vk = 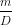 =
= 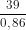 = 45,35 cm3.
= 45,35 cm3.
VCu =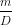 =
= 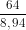 = 7,16 cm3.
= 7,16 cm3.
Bài 5. Hãy kể tên 3 kim loại được sử dụng để:
a) làm vật dụng gia đình.
b) sản xuất dụng cụ, máy móc.
Lời giải:
a) Ba kim loại được sử dụng làm vật dụng gia đình là: sắt, nhôm, đồng.
b) Ba kim loại dược sử dụng sản xuất dụng cụ, máy móc là: sắt, nhôm, niken.
a) Kim loại vontam được dùng làm dây tóc bóng đèn điện là do có ............ cao.
b) Bạc, vàng được dùng làm ........... vì có ánh kim rất đẹp.
c) Nhôm được dùng làm vật liệu chế tạo vỏ máy bay là do ............. và ..........
d) Đồng và nhôm được dùng làm ............. là do dẫn điện tốt.
e ............. được dùng làm dụng cụ nấu bếp là do bền trong không khí và dẫn nhiệt tốt.
1. nhôm ; 2. bền ; 3. nhẹ ; 4. nhiệt độ nóng chảy ; 5. dây điện ; 6. đồ trang sức.
Lời giải:
a) nhiệt độ nóng chây
b) đồ trang sức
c) nhẹ, bền
d) dây diện
e) nhôm
Bài 4. Hãy tính thể tích 1 mol của mỗi kim loại (nhiệt độ, áp suất trong phòng thí nghiệm), biết khối lượng riêng (g/cm3) tương ứng là : Da/ = 2,7 ; DK = 0,86 ; DCu = 8,94.
Lời giải:
Thể tích mol là thể tích chiếm bởi M gam kim loại đó. Áp dụng công thức:
V =
VAl =
VCu =
Bài 5. Hãy kể tên 3 kim loại được sử dụng để:
a) làm vật dụng gia đình.
b) sản xuất dụng cụ, máy móc.
Lời giải:
a) Ba kim loại được sử dụng làm vật dụng gia đình là: sắt, nhôm, đồng.
b) Ba kim loại dược sử dụng sản xuất dụng cụ, máy móc là: sắt, nhôm, niken.

moclan26
- Bài viết : 56
Danh vọng : 5951
Đến từ : Thanh Hóa
 Similar topics
Similar topics» Giải bài tập SGK 8
» Giải bài tập hóa 8
» Giải bài tập vật lý 7
» giải thích câu tục ngữ ăn quả nhớ kẻ trồng cây
» Giải thích câu tục ngữ đói cho sạch rách cho thơm
» Giải bài tập hóa 8
» Giải bài tập vật lý 7
» giải thích câu tục ngữ ăn quả nhớ kẻ trồng cây
» Giải thích câu tục ngữ đói cho sạch rách cho thơm
Trang 1 trong tổng số 1 trang
Permissions in this forum:
Bạn không có quyền trả lời bài viết